Изучение кардиопротекторных свойств препарата гепакардин
Введение
Разработка и создание ветеринарных фармакологических средств гериартрической направленности представляет все больший и больший интерес для ветеринарной фармакологии [9, 17]. К обязательным эффектам средств, улучшающих качество жизни стареющих животных, можно отнести хондро-, гепато- и кардиопротекцию [15, 19].
Ранее был разработан и создан препарат ЧИН 3607 (Гепакардин) [16], включающий в себя экстракты растительного и животного происхождения. Доклинические и клинические исследования этого препарата выявили его высокую безопасность [1] и эффективность как хондро- и гепатопротектора [12, 13].
Учитывая, что у животных старшей возрастной группы, с которой приходится сталкиваться ветеринарному врачу, одна из часто встречающихся проблем – это хроническая сердечная недостаточность, вызванная изменениями в миокарде различной этиологии [4], а также учитывая свойства компонентов, входящих в состав препарата, на наш взгляд, было целесообразным изучение его возможных кардиопротекторных свойств на модели патологии сердца.
Известно [3, 5], что большие дозы адреналина способны вызывать у животных повреждение артерий и миокарда. Это повреждение бывает настолько выраженным, что в сердце возникают некротические очаги, неотличимые от инфарктных. Это и определило выбор методического подхода к исследованию кардиопротекторых свойств Гепакардина.
Выбирая адреналиновую модель, мы полагали, что, если препарат проявит защитные свойства в таких жестких условиях, то в других, более мягких условиях, он заведомо будет оказывать кардиопротекторный эффект.
Целью данного исследования было изучение кардиопротекторных свойств препарата Гепакардин на модели острого поражения миокарда крыс, вызванного введением 0,1%-го раствора адреналина гидрохлорида.
Материалы и методы
Изучение кардиопротектрных свойств препарата Гепакардин проводили на крысах линии Wistar, самцах, массой 380–400 г, с использованием адреналиновой модели инфаркта миокарда [6], в модификации [14]. Данная модификация, по совокупности факторов, является, на наш взгляд, наиболее оптимальной для изучения кардиопротекторых свойств новых препаратов и может быть использована для скриннинговых исследований.
Подопытные животные были разделены на 3 группы по 10 крыс в каждой:
1 группа – в течение 14 дней до однократного введения адреналина животные получали с кормом препарат Гепакардин ежедневно в дозе 50 мг/кг;
2 группа – однократное введение адреналина;
3 группа – контроль (интактные).
Для оценки эффективности профилактического применения препарата Гепакардин контролировали следующие показатели:
- выживаемость животных после введения адреналина;
- изменения на электрокардиограмме, снятой через 24 часа после введения животным адреналина. Кардиограмму крысам снимали на электрокардиографе CardiMax FX-7102 в стандартных отведениях I, II, III ( двухполюсные отведения от конечностей: I – левая и правая передние конечности, II – левая задняя и правая передняя конечности, III – левая задняя и левая передняя конечности) в спинном положении;
- наличие в сыворотке крови крыс тропонина I через 48 часов после введения адреналина. Определение содержания тропонина I осуществляли иммунохроматографическим методом ( HiSense TnI Card). Принцип метода основан на формировании окрашенной видимой полосы (комплекс антиген – антитело) в тестовой зоне устройства при взаимодействии антител к cTнI, иммобилизованных на твердой фазе теста с сТнI из образца крови;
- гистологическая картина миокарда крыс через 48 часов после введения адреналина. Материал для гистологического исследования сразу после взятия фиксировали в 10%-м нейтральном формалине. Фиксированный материал промывали водой, обезвоживали проводкой через спирты в возрастающей концентрации и заливали в парафин по общепринятой методике (Меджунов Г. В., 1968 г.). Из парафиновых блоков готовились гистологические срезы на микротоме толщиной 4–6 микрон, которые затем депарафинизировали и окрашивали гематоксилином и эозином. Оценка гистологичских срезов производилась с помощью бинокулярного светооптического микроскопа МИКМЕД-1 при увеличении х 400 и х 200.
Результаты и обсуждение
Как показали проведенные исследования, профилактическое применение препарата Гепакардин в течение двух недель до введения адреналина полностью предотвращало гибель подопытных животных (табл. 1).
Таблица 1.
Влияние профилактического применения препарата Гепакардин на выживаемость крыс и появление тропонина I в крови после введения адреналина
|
|
Группа
|
|
|
|
Показатель
|
№ 1 (Гепакардин+адреналин) n=10
|
№ 2 (адреналин) n=10
|
№ 3 (интактные) n=10
|
|
Выживаемость животных после адреналиновой нагрузки (%)
|
100
|
50
|
100
|
|
Появление тропонина I в сыворотке крови животных после адреналиновой нагрузки (% случаев)
|
40
|
100
|
0
|
Как представлено в таблице 1, все животные группы № 1 через 24 часа после введения адреналина остались живы, хотя в первые 12 часов проявляли сильную заторможенность; у некоторых крыс этой группы отмечалась одышка (дыхание ртом), судороги, цианоз слизистых оболочек.
В группе № 2 смертность в течение первых 12 часов после введения адреналина достигла 50 % . При вскрытии погибших животных данной группы патологические изменения наблюдались в грудной полости: легкие были гиперемированы, при разрезе и надавливании на легкие появлялась пенистая жидкость, кусочек легкого при погружении плавал в толще воды; сердце имело шаровидную форму, стенки его были утолщены и немного отечны; в носовой полости наблюдалось значительное количество серозной жидкости; в брюшной полости патологических изменений не выявили. Наблюдаемые при вскрытии павших животных патологоанатомические изменения могут указывать на отек легких кардиогенной природы, что и явилось основной причиной смерти. У выживших животных группы № 2 до конца эксперимента проявлялись признаки заторможенности и вялости.
Животные группы № 3 вели себя как обычно, отклонений в их поведении, потреблении корма и воды отмечено не было.
Через 24 часа после введения адреналина было проведено снятие кардиограммы у животных всех групп.
При снятии ЭКГ у крыс было установлено следующее.
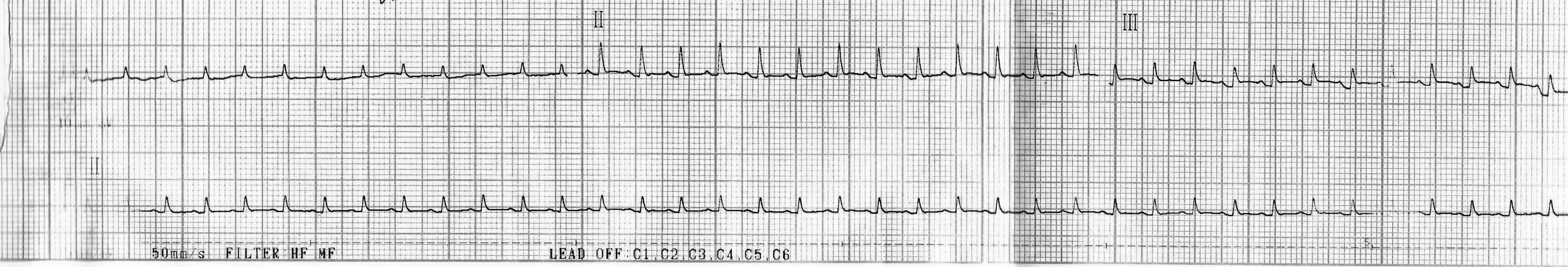
Группа №1:
- подъем сегмента ST выше изолинии и положительный зубец Т наблюдали лишь в двух случаях (рис. 1, 2, показано стрелками). Зона трансмурального повреждения мышечных волокон (после острого нарушения коронарного кровообращения) обуславливает регистрацию на ЭКГ подъема сегмента ST выше изолинии и слияние его с положительным зубцом Т;
- у трех крыс этой группы наблюдали значительное снижение вольтажа зубцов ЭКГ (рис. 3), в т. ч. зубца R. Высота зубца R уменьшается за счет образования зоны повреждения в миокарде [7];
- у остальных крыс данной группы выраженных отклонений по ЭКГ выявлено не было (рис. 4, 5).
Рис. 1. Кардиограмма крысы из группы № 1 через 24 часа после введения адреналина. 
Рис. 2. Кардиограмма крысы из группы № 1 через 24 часа после введения адреналина.
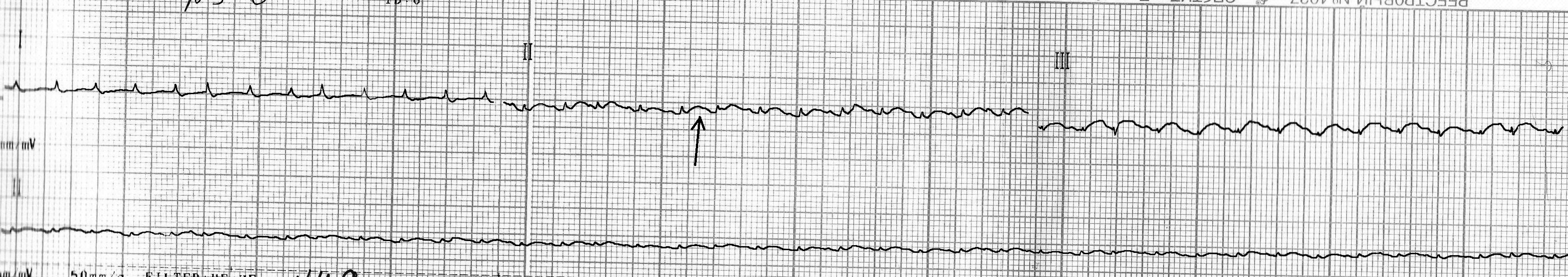
Рис. 3. Кардиограмма крысы из группы № 1 через 24 часа после введения адреналина.
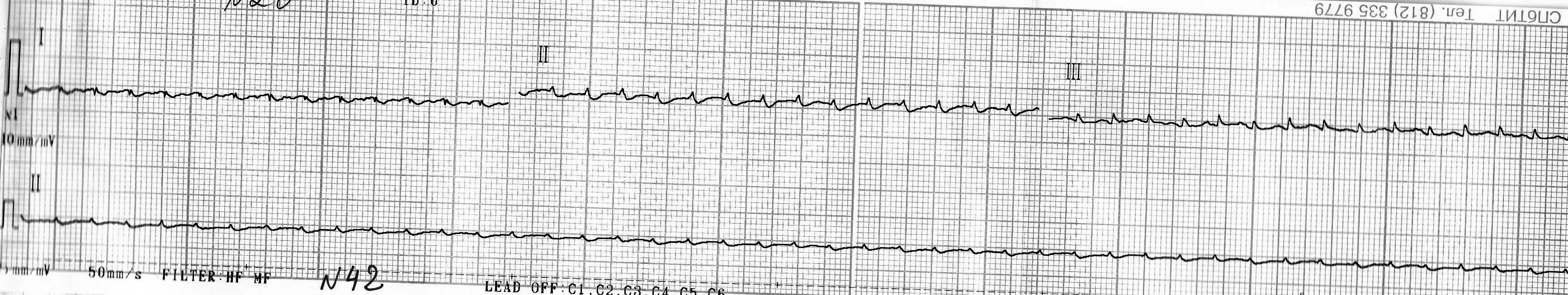
Рис. 4. Кардиограмма крысы из группы № 1 через 24 часа после введения адреналина.
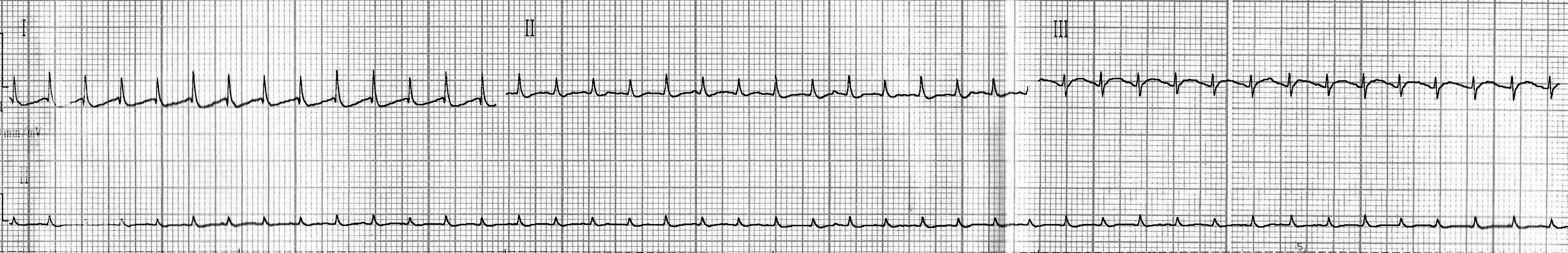
Рис. 5. Кардиограмма крысы из группы № 1 через 24 часа после введения адреналина.
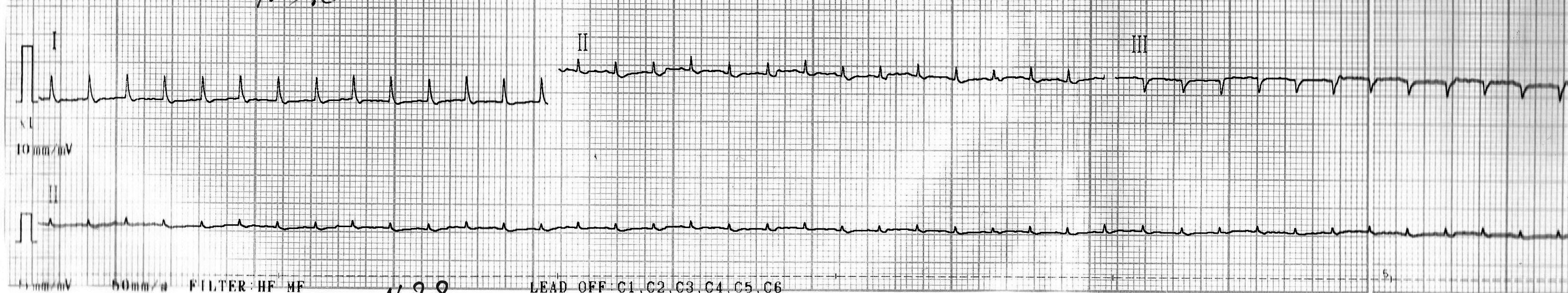
Группа № 2:
- подъем сегмента ST и положительный зубец T можно было четко наблюдать лишь на двух кардиограммах (рис. 6, 7, показано стрелками); на остальных трех вольтаж зубцов был слишком занижен (рис. 8), что может свидетельствовать о выраженной токсической кардиомиопатии [7];
- наблюдалось замедление сердечного ритма (рис. 7, 9).
Рис. 6. Кардиограмма крысы из группы № 2 через 24 часа после введения адреналина.
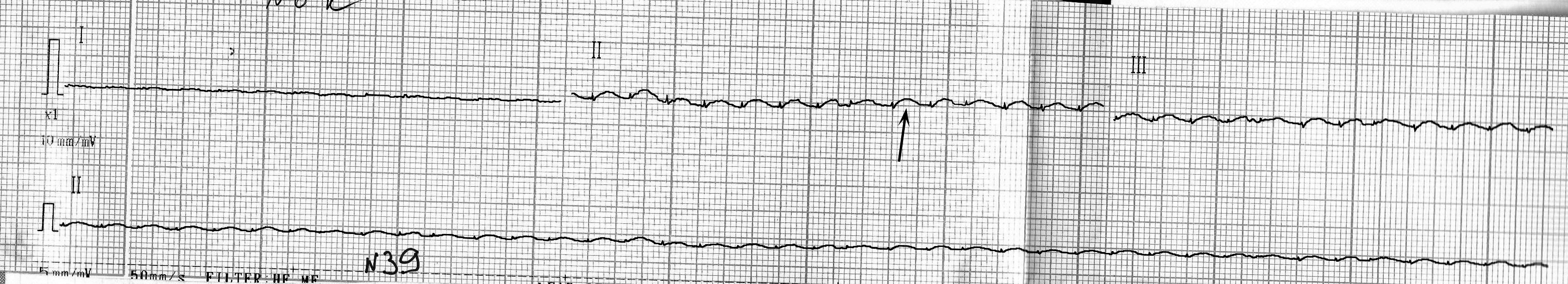
Рис. 7. Кардиограмма крысы из группы № 2 через 24 часа после введения адреналина.
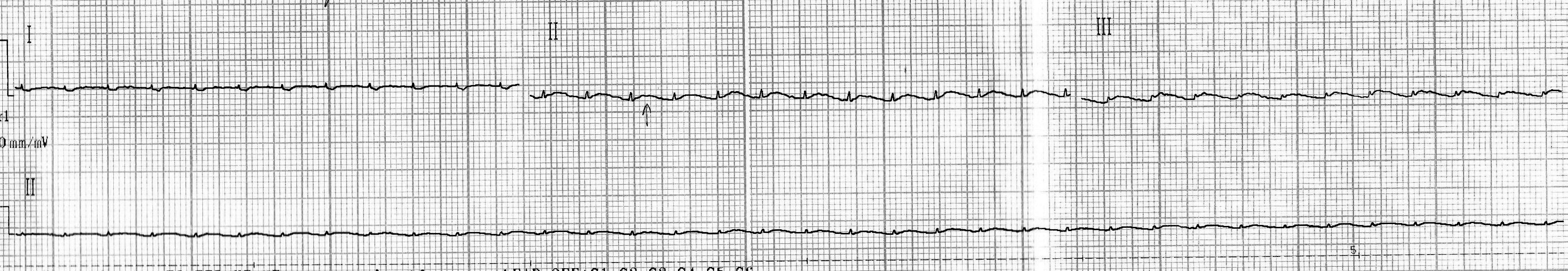
Рис. 8. Кардиограмма крысы из группы № 2 через 24 часа после введения адреналина.
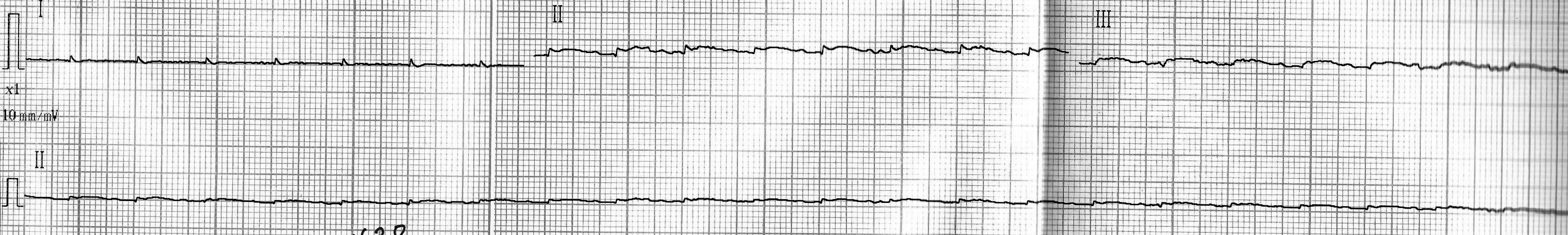
Рис. 9. Кардиограмма крысы из группы № 2 через 24 часа после введения адреналина.
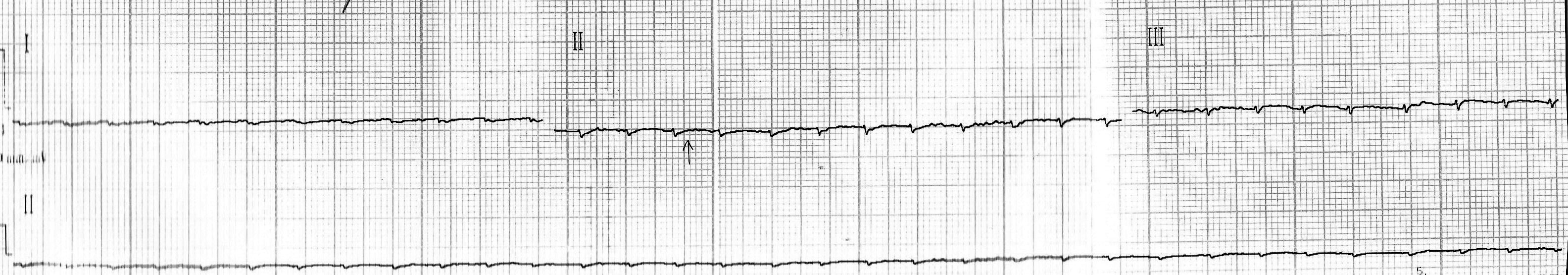
Группа № 3:
- на электрокардиограммах крыс из группы № 3 патологических изменений не выявлено.
Кардиограмма крысы, не подвергавшейся интоксикации.
Через 48 часов после введения адреналина все крысы были декапитированы, и в сыворотке крови каждой из них было проведено определение наличия тропонина I.
Результаты исследования представлены в таблице 1.
Как представлено в таблице 1, из десяти животных первой группы положительная реакция на наличие тропонина I была выявлена только у четырех (40 %). У животных второй группы (n=5) тропонин I был выявлен во всех пяти исследуемых образцах крови (100 %). У интактных животных (группа № 3, n=10), тропонин I обнаружен не был ни в одном образце крови (0 %).
Согласно современным представлениям, диагностическим критерием инфаркта миокарда, наряду с клиническими и электрокардиографическими признаками, являются лабораторные маркеры повреждения миокарда: креатинфосфокиназа и ее МВ-фракция, миоглобин, лактатдегидрогеназа и тропонины [10]. Наибольший интерес среди указанных маркеров представляет тропонин. Это связано с его высокой специфичностью, с ранним (от 3 до 12 часов) и продолжительным повышением показателя (в среднем до 7–8 суток), что делает возможным диагностику инфаркта миокарда ретроспективно.
Тропонины представляют собой белковые молекулы, формирующие состоящий из трех субъединиц (Тп С, Тп Т и Тп I) комплекс, расположенный на актиновых филаментах в поперечно-полосатой мускулатуре. Тропониновый комплекс участвует в процессах сокращения и расслабления миокарда. Тп С – Са2+-связанный протеин – участвует в регуляции деятельности актиновых филаментов. Тп I ингибирует процесс сокращения мышечных волокон при нарушении связи Тп С с ионами кальция. Тп Т обеспечивает взаимодействие всего тропонинового комплекса с тропомиозином и филаментами актина [18]. В то время как основная часть сердечных тропонинов фиксирована на сократительных белках, небольшое их количество (6–8 % Тп Т и 3,5 % Тп I) находится в свободном состоянии в цитозоле. В норме сердечные тропонины не попадают в системный кровоток, однако тропонин С встречается как в сердце, так и гладкомышечных волокнах других внутренних органов, поэтому не используется для диагностики инфаркта миокарда. Как маркеры повреждения миокарда используют тропонин Т или I. Определение как Тп Т, так и Тп I при условии использования качественных реагентов позволяет высокоинформативно диагностировать кардиомиопатию, и оба белка имеют эквивалентную диагностическую информативность.
Определение тропонинов – очень чувствительный тест, который позволяет подтвердить и мелкоочаговый инфаркт миокарда [2, 8]. Однако этот показатель может быть повышен не только при коронарной недостаточности, но и при сердечной недостаточности и/или гипертрофии миокарда на фоне артериальной гипертензии, т. е. при состояниях, сопряженных с повреждением кардиомиоцитов. И тем не менее на сегодняшний день тропонины Т и I рассматриваются как наиболее значимые и специфичные маркеры повреждения миокарда [11].
Таким образом, учитывая результаты, полученные по определению тропонина I в крови испытуемых животных после адреналиновой нагрузки, можно говорить о достаточно высоком профилактическом кардиопротекторном действии препарата Гепакардин.
Кроме сыворотки крови, у животных всех трех групп через 48 часов после введения адреналина для гисто-морфологического исследования был взят миокард.
При гистологическом исследовании миокарда было обнаружено следующее.
Группа № 1:
- в образцах сердечных мышц была выявлена зернистая дистрофия: набухание цитоплазмы, нечеткие границы клеток и ядра; ядра кардиомиоцитов были слабо окрашены, с нечеткими границами; сарколемма сохранена; окраска мышечных волокон неоднородна (рис. 10, 11, 12).
Группа № 2:
- в образцах сердечных мышц были обнаружены изменения, свойственные некробиозу кардиомиоцитов: отсутствие сарколеммы, сильное набухание и глыбчатость цитоплазмы; лизис ядер, а в некоторых клетках – полное их отсутствие (рис. 13, 14); в некоторых образцах миокарда обнаружили участки с более светлой окраской мышечной ткани, что дает возможность предположить ишемию (рис. 15, 16).
Группа № 3:
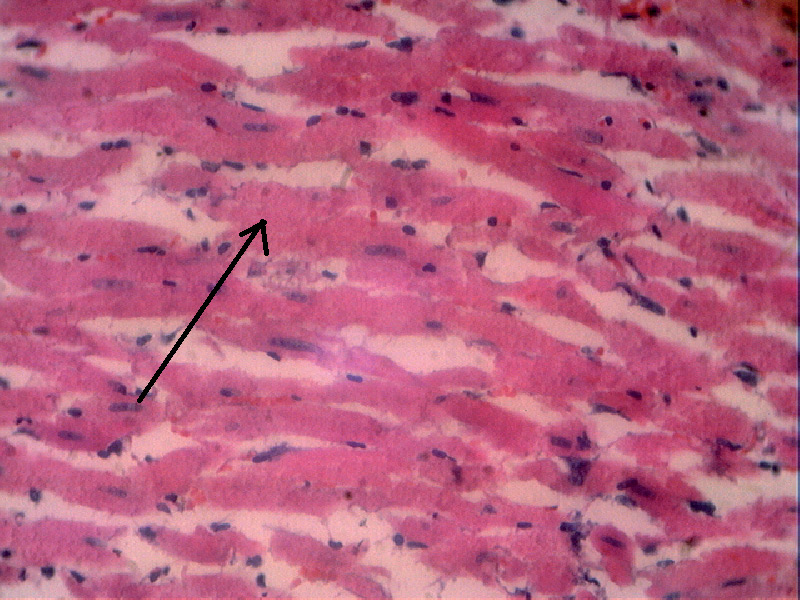
- в образцах сердечных мышц выраженных изменений не обнаружено (рис. 17): ядра кардиомиоцитов были хорошо видны, имели удлиненно-овальную форму, располагались ближе к центру цитоплазмы и своей длинной осью были ориентированы параллельно сарколемме; в саркоплазме видны поперечные полосы; цитоплазма некоторых кардиомиоцитов неравномерно или очень насыщенно окрашена; сарколемма четко определялась.
Рис. 10. Гистологическая картина миокарда крысы первой группы через 48 часов после адреналиновой нагрузки (в продольном сечении). Увеличение х 400.
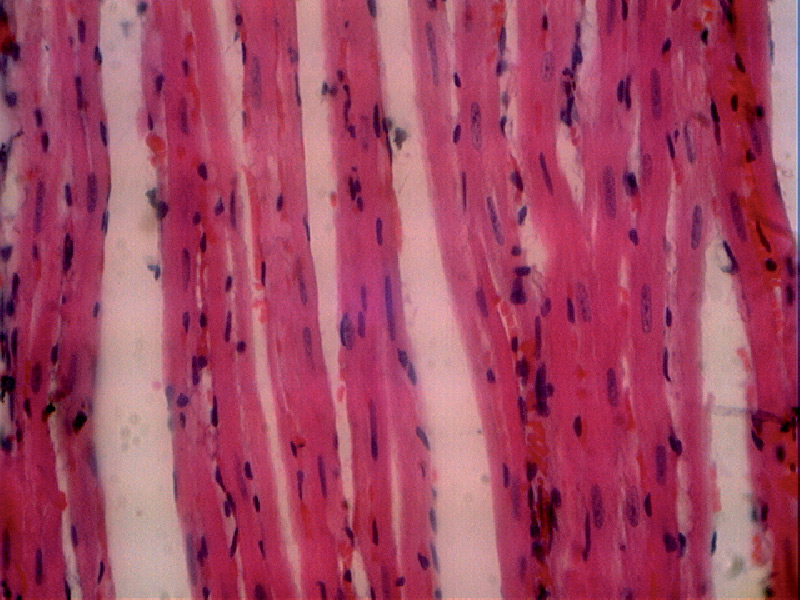
Рис. 11. Гистологическая картина миокарда крысы первой группы через 48 часов после адреналиновой нагрузки (стрелкой показано набухание цитоплазмы). Увеличение х 400.
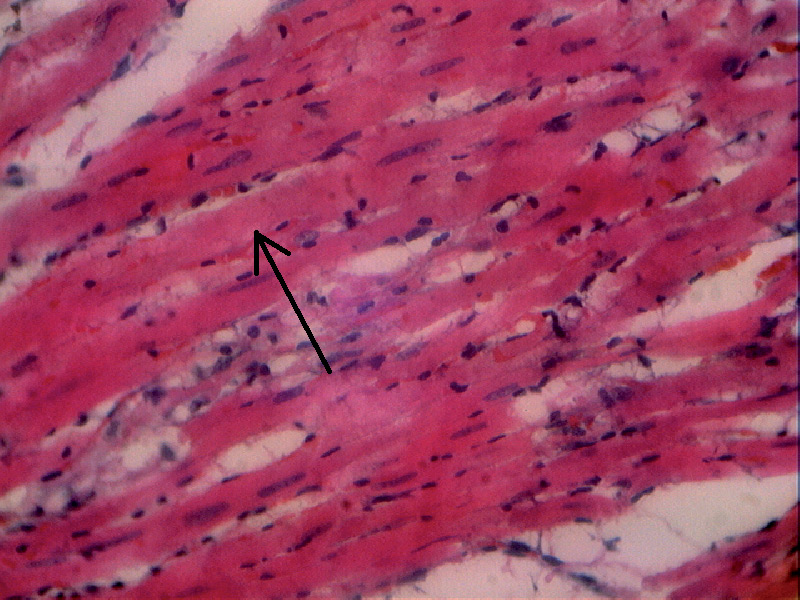
Рис. 12. Гистологическая картина миокарда крысы первой группы через 48 часов после адреналиновой нагрузки (стрелками показаны нечеткие границы ядер, набухание цитоплазмы). Увеличение х 400.
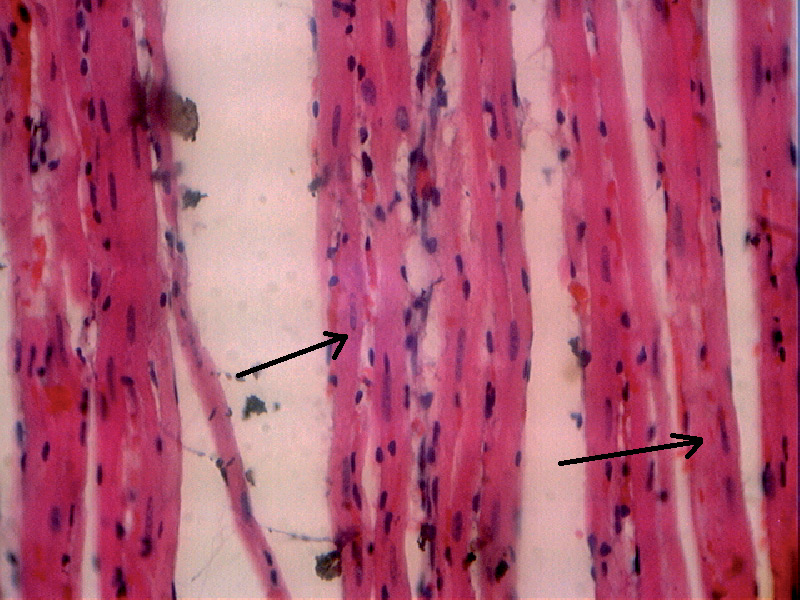
Рис. 13. Гистологическая картина миокарда крысы второй группы через 48 часов после адреналиновой нагрузки (стрелкой показаны набухание (глыбчатость) цитоплазмы, нечеткие границы ядер в кардиомиоцитах). Увеличение х 400.
Выводы
1. Однократное введение крысам раствора адреналина гидрохлорида подкожно в дозе 4 мг/кг вызывает гибель 50 % испытуемых животных в течение первых 12 часов после введения адреналина.
2. Профилактическое применение препарата Гепакардин крысам в течение 14 дней в дозе 50 мг/кг предотвращает гибель животных от адреналиновой нагрузки (4 мг/кг).
3. Однократное введение крысам раствора адреналина гидрохлорида подкожно в дозе 4 мг/кг приводит через 24 часа к четким изменениям кардиограммы животных, характерным для некроза клеток сердечной мышцы (инфаркта миокарда).
4. Профилактическое применение препарата Гепакардин крысам в течение 14 дней в дозе 50 мг/кг в значительной степени предотвращает появление на кардиограмме изменений, характерных для инфаркта миокарда, вызванного адреналиновой нагрузкой (4 мг/кг).
5. Однократное введение крысам раствора адреналина гидрохлорида подкожно в дозе 4 мг/кг вызывает через 48 часов появление в сыворотке крови тропонина I у 100 % испытуемых животных.
6. Профилактическое применение препарата Гепакардин крысам в течение 14 дней в дозе 50 мг/кг предотвращает появление тропонина I в сыворотке крови у 60 % крыс, подвергшихся адреналиновой нагрузке (4 мг/кг).
7. Однократное введение крысам раствора адреналина гидрохлорида подкожно в дозе 4 мг/кг вызывает через 48 часов гистологические изменения в миокарде, характерные для начальной стадии некроза кардиомиоцитов.
8. Профилактическое применение препарата Гепакардин крысам в течение 14 дней в дозе 50 мг/кг предотвращает гистологические изменения в миокарде, характерные для начальной стадии некроза кардиомиоцитов у крыс с адреналиновой нагрузкой (4 мг/кг).
Список литературы:
1. Глотова, С. В. Изучение острой и хронической токсичности препарата ЧИН 3607 (Гепакардин) / С. В. Глотова // Актуальные вопросы ветеринарной биологии – 2009. – № 2 (2) – С. 15–18.
2. Гогин, Е. Е. Острый коронарный синдром: этапы диагностики, определяющие тактику оказания помощи / Е. Е. Гогин // Терапевтический архив. – 2001. – № 4. – С. 5–11.
3. Гофман, Б. Катехоламины и средства, влияющие на адренэргическую передачу / Б. Гофман // Клиническая фармакология по Гудману и Гилману. Книга 1. – М., 2006. – С. 185.
4. Дейвис, Майк. Гериатрия собак и кошек / М. Дейвис. – М. : Аквариум, 2002. – С. 25.
5. Меерсон, Ф. З. Патогенез и предупреждение стрессорных и ишемических повреждений сердца / Ф. З. Меерсон. – М. : Медицина, 1984. – 269 с.
6. Непомнящих, Л. М. Альтернативная недостаточность мышечных клеток сердца при метаболических и ишемических повреждениях / Л. М. Непомнящих. – М., 1998. – С. 56.
7. Орлов, В. Н. Руководство по электрокардиографии / В. Н. Орлов. – М., 1983. – С. 67.
8. Сапрыгин, Д. Б. Современная диагностика и оценка острого коронарного синдрома: значение определения тропонинов / Д. Б. Сапрыгин // Лечащий врач. – 2005. – № 4. – С. 54–56.
9. Соколов, В. Д. Гериатрическое направление в ветеринарной фармакологии / В. Д. Соколов, И. В. Чуваев // Материалы первого международного конгресса ветеринарных фармакологов и токсикологов «Эффективные и безопасные лекарственные средства», СПб., 2008. – С. 58.
10. Трифонов, И. Р. Биохимические маркеры некроза миокарда. Общая характеристика биомаркеров, их применение для диагностики инфаркта миокарда: обзор современных рекомендаций / И. Р. Трифонов // Кардиология. – 2001. – № 11. – С. 93–95.
11. Целуйко, В. И. Уровень тропонина I и клиническое течение инфаркта миокарда / В. И. Целуйко, Е. Г. Почепцова, С. М. Карлов // Экспериментальная и клиническая медицина. – 2003. – № 3–4. – С. 67–71.
12. Чуваев, И. В. Изучение гепатопротекторных свойств препарата ЧИН 3607 на модели острого гепатита / С. В. Глотова, И. В.Чуваев, Н. Л. Андреева // Ветеринарная практика. – 2008. – № 3 (42). – С. 116–121.
13. Чуваев, И. В. Клинические испытания препарата Гепакардин на собаках старшей возрастной группы / И. В. Чуваев, С. В. Глотова, Н. Л. Андреева // Актуальные вопросы ветеринарной биологии. – 2009. – № 4 (4). – С. 24–30.
14. Чуваев, И. В. Оптимизация адреналиновой модели инфаркта миокарда на крысах / И. В. Чуваев, С. В. Глотова // Материалы Всероссийского съезда ветеринарных фармакологов и токсикологов «Эффективные и безопасные лекарственные средства в ветеринарии», СПб., 2009. – С. 28–31.
15. Чуваев, И. В.Сравнительный анализ обращений владельцев собак в клинику «Институт Ветеринарной Биологии» за 1998 и 2008 гг. / И. В. Чуваев, В. Д. Соколов, С. В. Глотова // Материалы всероссийского съезда ветеринарных фармакологов и токсикологов «Эффективные и безопасные средства в ветеринарии», 2009. – С. 90.
16. Чуваев, И. В. Необходимость изыскания гериатрических средств для плотоядных / И. В. Чуваев, В. Д. Соклов, С. В. Глотова // XIX Международная научно-практическая конференция по фармакологии и токсикологии : [материалы]. – СПб, 2007.
17. Cupp, C. J. The role of nutritional interventions in the longitive and maintenance of long-term health in aging cats / C. J. Cupp, W. W. Kerr, C. Jean-Philippe // Intern Journal Appl. Res. Vet. Med. – 2008. – N 6. – Р. 69–81.
18. Korff, S. Heart //. S. Korff, H. A. Katus, E. Giannitsis. – 2006. – V. 92. – Р. 987–993.
19. Witte, P. Ортопедические болезни стареющих кошек / P. Witte, H. Scott // Veterinaty focus. – N 19 (3), 2009. – С. 46–49.