Коронавирусная инфекция: патогенез, диагностика, лечение
Источник: http://vettest.ru/
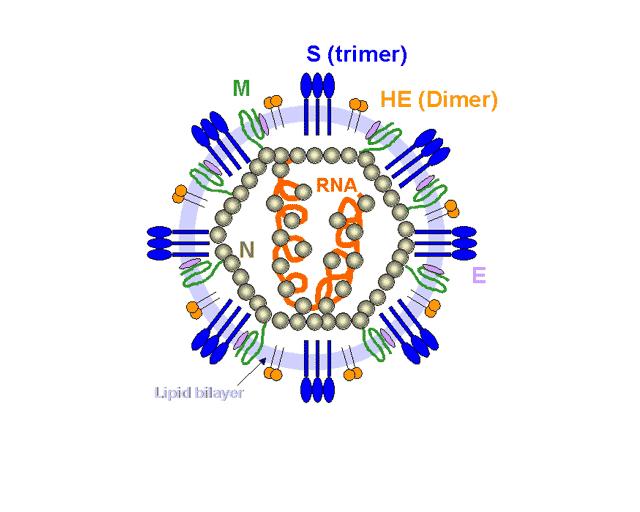
Коронавирус кошек (FCoV) относится к роду Alphacoronavirus семейства Coronaviridae, геном представлен одноцепочечной молекулой РНК, кодирующей три структурных белка. Коронавирусы широко распространены среди кошек во всем мире, отмечается, что серопозитивными являются до 90% кошачих (Pedersen NC. 2009), как правило, передается горизонтально фекально-оральным путем, и может привести к хрони-ческой инфекции, однако клинические проявления встречаются в менее чем 10 % инфицированной популяции (Herrewegh AA, Mähler M, 1997, Pedersen NC. 2009).
Коронавирус кошек разделяют на два серотипа: I и II. (Hohdatsu T 1991). Тип I является причиной клинических проявлений у кошек в 90 % случаях инфекции (Kennedy M 2002). Тип II коронавируса кошек являетя рекомбинантом между типом I кошек и близкородственным коронавирусом собак (Decaro N., 2008). Вне зависимости от типа течение коронавирусной инфекции может протекать двумя путями. В одном случае течение коронавирусной инфекции может протекать в кишечной форме в виде легкого энтерита и хронической инфекции. В другом случае инфекция может протекать в виде инфекционного перитонита (Feline infectious peritonit (FIP)), который вызывает иммунопатологиче-ские заболевания, сопровождающиеся системным воспалением серозных оболочек различных органов и скоплением экссудата в грудной клетке и брюшной полости (асцит) (Pedersen NC. 2009).
Рис. 1. Структурная организация коронавируса кошек.
Как указывалось выше, заражение происходит горизонтальным фекально-оральным путем. При заражении происходит репликация вируса в эпителиальных клетках ротоглотки и верхних дыхательных путей. Организм вырабатывает противовирусные антитела. Вирус захватывается макрофагами и моноцитами, которые разносят его по всему организму и концентрируют его в периваскулярных тканях, где происходит повторная репликация (Fred W. Scott, 1991). Инфекция сопровождается лейкопенией, на ранней стадии лейкоцитозом, нейтрофелией и лимфопенией при длительном течении.
Спектр клинических проявлений зависит от патогенности и вирулентности вируса, эффективности иммунного ответа, локализации и характера поражений. По какому типу будет развиваться патогенез предсказать практически невозможно, не была установлена зависимость от типа вируса с течением инфекционного процесса (H. Vennema, 1998). На практике трудно определить тип коронавируса и отличить его от маловирулентных и авирулентных кишечных штаммов. Течение патогенеза связывают с мутациями в определенных участках генома вируса, которые могут влиять на вирулентность вируса. Есть работы, в которых определяли вирулентность с использованием технологии секвенирования генома (A. A. Herrewegh, 1995, N. C. Pedersen, 2009).
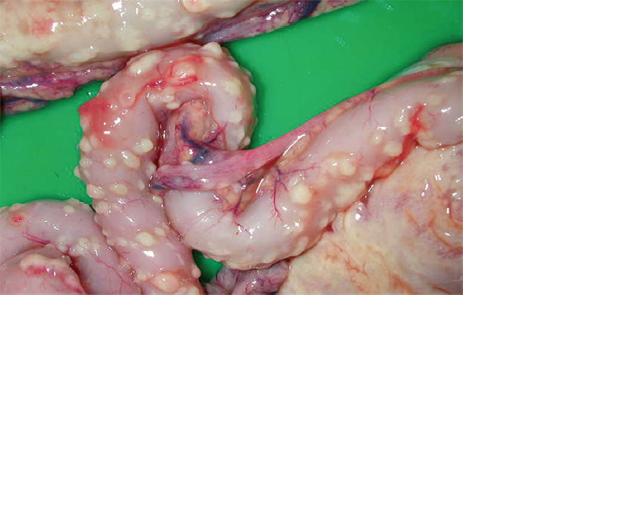
Рис. 2. Скопление асцитной жидкости в Рис. 3. Серозное воспаление стенок ки-
брюшной полости (Saeed S. 2010). шечника (Saeed S. 2010). 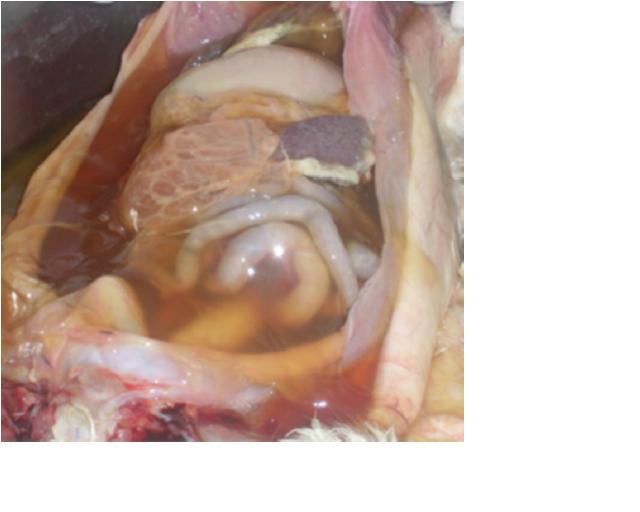
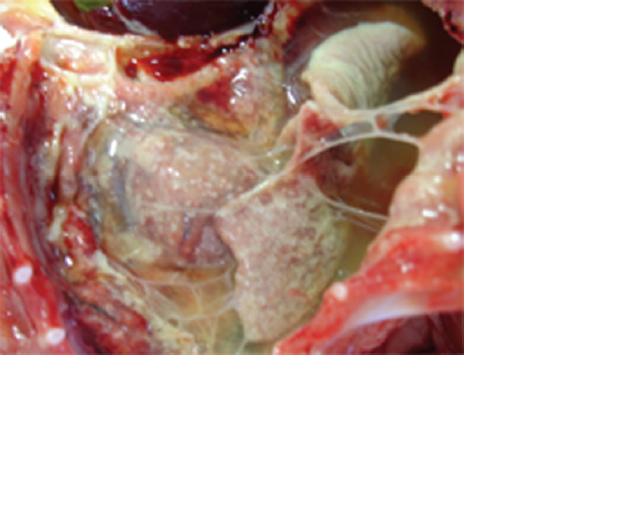
Рис. 4. Плевральная полость кошки, при инфекционном перитоните (Saeed S. 2010).
Методы диагностики.
Наличие антител в организме животного определяется методом иммуноферментного анализа (ИФА) и иммуннохроматографией (ИХ). Поскольку выявление антител это опо-средованное выявление возбудителя, то их обнаружение еще не свидетельствует от том что клинические признаки связаны с коронавирусной инфекцией. Антитела в организме могут образовываться в ответ и на вакцинацию. Кроме того, антитела могут не обнаруживаться в период так называемого серологического окна, когда они еще не успели обра-зоваться в организме, а случае с молниеносным течением FIP важное значение имеет именно раннее выявление патогена. Поскольку коронавирусная инфекция сопровождается подавлением иммунитета, то антитела могут и необнаруживаться. В связи с этим важным является непосредственное выявления возбудителя заболевания.
К прямым методам выявления вируса относятся ИХ (в случае выявления антигена) и ПЦР. Эти методы непосредственно обнаруживают присутствие вируса в организме живот-ного.
Метод ПЦР позволяет выявить коронавирус на самых ранних этапах инфицирования, когда вирус еще только начинает свое развитие в макрофагах и моноцитах крови, при очень низкой концентрации вируса в организме. При подозрении на заражение или при появлении первых клинических признаках нужно исследовать кровь на наличие возбудителя.
По сравнению с ИХ метод ПЦР обладает более высокой чувствительностью, поэтому этот метод является более предпочтительным.
Поскольку геном вируса довольно вариабелен, то существующие на рынке ПЦР тест-системы со временем могут терять чувствительность, поэтому время от времени в них нужно вносить своевременные коррективы. В лаборатории ВЕТТЕСТ ведется постоянный мониторинг таких изменений на основе большой статистики сравнительного парал-лельного тестирования различными методами клинических образцов. На основе этой статистики вместе с производителем тест-систем лаборатория имеет уникальную возмож-ность вносить своевременные изменения в состав тест-систем для увеличения их ыувствительности.
К сожалению ни один из вышеперечисленных методов не может дать информацию о вирулентности вируса. Поэтому даже при обнаружении вируса в организме животного не может говорить о заболевании. Обнаружение вируса может быть связано с хроническим течением или с носительством. Метод ИХ в отношении вариабельности вируса более стабилен, поскольку изменение генома, как правило не отражается на белковых структурах вируса, поэтому в некоторых случаях выявляемость может быть выше чем у метода ПЦР, однако у него ниже чувствительность.
На практике не существует стопроцентного достоверного метода выявления вируса. В связи с этим для достоверной постановки диагноза необходимо комбинировать несколько методов диагностики, сопоставляя результаты с клиническими признаками.
Виды исследований на короновирусную инфекцию проводимые в лаборатории ВЕТТЕСТ:
Короновирусный гастроэнтерит
ПЦР
Материал: фекалии, ректальный мазок, кровь с ЭДТА
Тара: пластиковая стерильная баночка с красной крышечкой и ложечкой, Пробирка типа эппендорф, Пробирка с ЭДТА с красной крышкой
ИХ (АГ)
Материал: фекалии, ректальный мазок
Тара: пластиковая стерильная баночка с красной крышечкой и ложечкой, Пробирка типа Эппендорф
Вирусный перитонит кошек
ПЦР
Материал: кровь с ЭДТА, выпотные жидкости
Тара: пробирка с ЭДТА с красной крышкой, шприц
ИХ (АТ)
Материал: кровь с ЭДТА, сыворотка, выпотные жидкости
Тара: пробирка с ЭДТА с красной крышкой, Белая пробирка с гранулами, шприц
Лечение.
Специфических проивокоронавирусных препаратов не существует. При хроническом течении или носительстве специфического лечения не назначают. За животным устанав-ливается наблюдение. В условиях группового содержания животное, у которого обнаружен коронавирус желательно изолировать.
При проявлении гастроинтерита вызванных коронавирусом назначают иммуностимулирующие препараты и проводят симптоматическое лечение.
Эффективных схем лечения при вирусном кошачьем перитоните нет. Поскольку инфекционный перитонит является иммуноопосредованным заболеванием, лечение часто на-правляют на регуляцию иммунного ответа на вирус. Обычно используют иммуносупрессивную терапию, применяя глюкокортикоидные препараты. При развитии вторичной инфекции используют антибиотики. Аспирация асцитной жидкости малоэффективна, как правило, жидкость довольно быстро набирается вновь, и данная манипуляция прино-сит только временное облегчение.
В любом начинать лечение необходимо как можно раньше, при соблюдении режимов кормления и гигиены содержания больного животного.
По всем вопросам можете обращаться по тел:
8(929)945-70-47 зав. лаб. Зайцев Валерий Сергеевич
8(495)769-28-29 8(495)340-28-29 ветеринарная лаборатория ВЕТТЕСТ