Хламидиоз кошек – миф или реальная опасность?
Источник: http://www.vetseminar.ru/
Инфекция, вызванная Chlamydophila felis (ранее Chlamydia psittaci), впервые была описана у кошек в 1942 году Бейкером. Он впервые не только выделил хламидию, но и описал клинические признаки заболевания вызванные ею.
Согласно новому определению, предложенному K.D.E. Everett в 1999 году, "порядок Chlamydiales включает облигатных внутриклеточных бактерий, которые имеют сходный с хламидийным цикл развития, характеризуются наличием грамположительных или грамотрицательных инфекционных элементарных телец (ЭТ) и обладают >80% уровнем гомологии по последовательности 16S и 23S рРНК генов" (6).
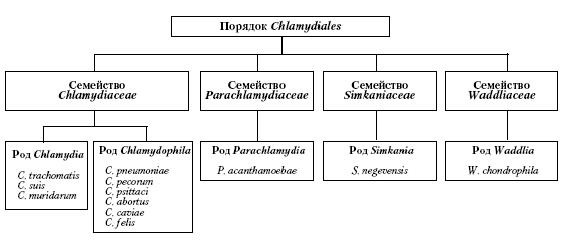
ВОЗБУДИТЕЛЬ. В настоящее время порядок Chlamydiales включает семейство Chlamydiaceae, а также представленные единичными видами семейства Simkaniaceae, Parachlamydiaceae и Waddliaceae (см. рисунок). Включение новых микроорганизмов в порядок Chlamydiales соответствует критериям, установленным, для определения бактериального класса на основании более 80% идентичности в генах 16S рРНК. Однако, поскольку новые группы в настоящее время включают небольшое количество видов, решение относительно того, должны ли Chlamydiales становиться классом или оставаться порядком, по мнению K. Everett, "может быть отложено до получения большей информации о новых группах хламидий" (6).
Все представители порядка Chlamydiales характеризуются двухфазным циклом развития, состоящим из чередования функционально и морфологически различных форм – элементарных телец (ЭТ) и ретикулярных телец (РТ).
ЭТ представляют собой метаболически неактивные круглые клетки диаметром 0,2-0,6 мкм, имеющие внутреннюю и наружную мембраны и вариабельное периплазматическое пространство. Цикл размножения хламидий инициируется при поглощении ЭТ эукариотической клеткой вследствие эндоцитоза. На этой стадии ЭТ постоянно находятся внутри цитоплазматических включений, где увеличиваются до 0,6-1,5 мкм, превращаясь в РТ и претерпевая многократное деление. Включения представляют собой уникальные вакуоли, которые не подвергаются окислению и не сливаются с лизосомами. Через некоторое время РТ уплотняются в ЭТ, которые выходят из хозяйской клетки путем экзоцитоза или разрыва клеточной мембраны. Инфекционный цикл, таким образом, не требует наличия промежуточного хозяина. Многие виды порядка Chlamydiales способны к латентному существованию или персистенции в организме хозяина (1).
ПАТОГЕНЕЗ И КЛИНИЧЕСКИЕ ПРИЗНАКИ. Основным местом жизнедеятельности микроорганизма являются эпителиальные ткани. Наиболее часто Chlamydophila felis обнаруживают в эпителии конъюнктивыв виде включений в цитоплазму клеток. Chlamydophila felis находится в клетке около 48 часов, после чего пораженная микроорганизмом клетка погибает с выделением возбудителя в окружающие ткани.
При экспериментальном инфицировании в конъюнктивальный мешок клинические признаки заболевания проявлялись у кошек на 3-5 дни после заражения. В естественных условиях от момента обнаружения антигена в организме до появления клинических признаков время увеличивалось до 14 суток.
Первыми клиническими признаками заболевания в большинстве случаев являются серозные выделения из глаз, блефароспазм, гиперемия и пролапс третьего века. Часто в начале заболевания поражается один глаз, а второй вовлекается в процесс через 1-20 дней. На 3-5 день болезни с вовлечением секундарной инфекции, развивается гнойный конъюнктивит (3,11). По мимо инфицирования конъюнктивы, Chlamydophila felis выделяли в других органах.
Так Hardis выделял данный микроорганизм из желудочно-кишечного тракта (ЖКТ) кошек после их гибели с диагнозом гастоэнтерит. Однако четкая взаимосвязь между гибелью кошек и поражением ЖКТ не была выявлена (7).
Darougar выделял Chlamydophila felis у абортировавших кошек (4), а Wills обнаруживал хламидиоз в мазках из влагалища спустя неделю после обнаружения её в конъюнктивальных смывах у больных кошек. Но инфицирование половых органов Chlamydophila felis не коим образом не было связано с характером выделений из влагалища (8).
Shewen выделял Chlamydophila felis у беременных кошек, после чего наблюдали конъюнктивиты у котят после рождения от данных животных. А при исследовании в ряде питомников Shewen обнаруживал причинно-следственную связь между абортами или аномальным развитием плодов и инфицированием Chlamydophila felis кошек (18).
Wills в более поздних работах отмечал, что кошки у которых выделяли хламидийную инфекцию из конъюнктивы или половых органов воспроизводили на свет здоровое потомство. Однако кошки с клиническими признаками хламидиоза и выделением микроорганизма из половых органов чаще абортировали, чем клинически здоровые кошки и кошки у которых Chlamydophila felis выделяли только из конъюнктивальных выделений (13).
Также было отмечено, что в выделениях из конъюнктивы хламидий можно обнаружить в течении 18 месяцев с момента заболевания, а в мазках из половых органов или ректальных до 7 месяцев после появления клинических признаков хламидиоза (13,18).
РАСПРОСТРАНЕНИЕ. В ряде исследований проведенных в США кошки инфицированные хламидиями составил около 10% общего количества с признаками конъюнктивита (5).
Daroupar (1977) и Johnson (1984) выделяли Chlamydophila felis исследование кошек с признаками конъюнктивита в Великобритании. А в 1984 году Wills провел широкомасштабное исследование в котором выяснил, что у 30% домашних кошек с признаками конъюнктивита были выделены хламидии (4,8,13).
ДИАГНОЗ. В настоящее время имеется несколько методов выделения Chlamydophila felis. Эти методы используют родо-специфичные моноклональные или поликлональные антитела в иммуноферментном анализе. Однако в исследованиях Wills было показано, что выделение Chlamydophila felis в клеточных культурах более информативно, чем иммуноферментные методы.
Положительная серологическая реакция или повышения титра антител помогают в диагностике хламидиоза, однако не все кошки, инфицированные Chlamydophila felis, положительно реагируют в реакции связывания комплемента (РСК) или показывают повышенные титры антител (13,17).
ЛЕЧЕНИЕ. Хламидии имеют схожую с грамотрицательными бактериями клеточную стенку, поэтому они чувствительны к некоторым антибактериальным препаратам. Антибиотики тетрациклинового ряда являются препаратами выбора при лечении хламидиоза. По данным El Sheikth наилучшим антибиотиком тетрациклинового ряда является доксациклин (5).
По ряду других исследований хорошо себя зарекомендовали макролиды и в частности азитромицин (2,9).
ИММУНИТЕТ. Естественный иммунитет к хламидийной инфекции незначительный и крайне редко может защитить кошку от Chlamydophila felis.
После излечения кошек от хламидиоза иммунитет так же не образуется. Однако колостральные антитела, получаемые с молоком от лактирующих кошек, защищают котят до возраста 6-9 недель (10,14).
При вовлечении в процесс вирусной инфекции вероятность тяжелых осложнений и летального исхода увеличивается в разы (15).
На данный момент существует ряд вакцин для активной иммунизации кошек против Chlamydophila felis. Однако ни одна вакцина не дает 100% защиты от заболевания.
Лучшие результаты были получены после применения живых вакцин, нежели инактивированных (12,16).
ЛИТЕРАТУРА.
- Клиническая микробиология и антимикробная химиотерапия т.1 стр 5-11 1999г
- Равилов Р.Х., Исхаков Г.М., Кашов В.М. «Антибиотико- и иммунотерапия при хламидиозе собак и кошек.» Сборник статей выпуск 4. с136-139.
- Сello R.M. (1971a) Microbiological and immunologic aspects of feline pnevmonitis.
- Darougar S., Monnickendam M.A., El-Sheikh H. (1997) Animal models for the study of chlamidial infections of the eye and genetal tract.
- El Sheikth (1978) Feline chlamidial kcratoconjunctivitis as an analogue of trachoma.
- Everett K.D.E.et al.Emended description of the order Chlamydiales, proposal of Parachlamydiaceae fam.nov. and Simkaniaceae fam.nov.,each containing one mono typic genus, revised taxonomy of the family Chlamydiaceae, including a new genus and five new species, and standards for the identification of organisms //Inter.J.Syst.Bacterial.v1999.v Vol.49.v P.415 v440.
- Hardis A.M., Prieur D.J., Gaillard E.T. (1983) Chlamydial infection of the gastric mucosa in twelve cats. Vet. Pathol. 20, 170-8.
- Johnson F. W.A. (1984) Isolation of Chlamydia psittaci from nasal snd conjunctival exudates of a domestic cat, Vet. Rec. 114, 342-4.
- Kahn D.E., Hoover E.A. (1976) Infectious respiratory diseases of cats. Ver. Clin. North Am. 6(3), 399.
- Wills J.M. (1986a) Chlamydial infection in the cat. PhD Thesis, University of Bristol.
- Wills J.M. (1986b) Chlamydial zoonoses. J. Small Anim. Pract. 27, 717-31.
- Wills J.M. (1988) Feline chlamydial infection (feline pneumonitis). In Chandler E.A. (ed) Advances in small Animal Practice 1. Blackwell Scientific Publications, Oxford.
- Wills J.M., Gruffydd-Jones T.J., Richmond S.J., Paul I.D. (1984) Isolation of Chlamydial psittaci from cases of conjunctivitis in a colony of cats. Ver. Rec.114, 344-6.
- Wills J.M., Gruffydd-Jones T.J., Bourne F.J., Richmond S.J., Gaskell R.M. (1987) Effect of vaccination on feline Chlamydia psittaci infection. Infect. Immun. 55, 2653-7.
- Wills J.M., Millard W.G., Howsrd P.E. (1986) Evaluation of a monoclonal antibody based ELBA for detection of feline Chlamydia psittaci. Vet. Rec. 119, 418-20.
- Wills J.M., Howsrd P.E. Gruffydd-Jones., Wathers C.E. (1988a) Prevalence of Chlamydia psittaci in different cat popuiations in Britain. /Small Anim. Pract. 29, 327-39.
- Wills J.M., Robets K., Gruffydd-Jones T.J., Richmond S.J.(1988b) Transmission of feline Chlamydia psittaci from dam to kittens. In Proceedings of the European Society for Chlamydia Research, p. 61.
- Shewen P.E., Povey R.C. (1978) Feline chlamydial infection. Can.Vet. J. 19, 289-292.